
摘 要:奶牛乳房炎每年在全球造成巨大的经济损失,抗生素之前一直被用作治疗乳房炎的主要手段。然而,抗生素滥用导致了耐药菌株的出现和畜产品药物残留等问题。随着国家对食品安全、生物安全等问题愈发关注,饲料减抗、禁抗等政策相继出台,在奶牛乳房炎防治方面亟需寻求绿色安全的替抗手段。本文对微生态制剂在奶牛乳房炎防治方面的研究进展进行了综述,以期为治疗奶牛乳房炎和提高乳品质量安全提供绿色的替抗思路。
关键词:乳房炎;微生态制剂;肠道微生物;免疫;抑菌
奶牛乳房炎主要是由病原微生物侵入引起的奶牛乳腺组织炎性疾病,机械因素、环境因素、用药不当等都可引起奶牛乳房炎[1]。当病原体突破乳头的防御时,它会进入乳腺并向乳池移动,此时介导身体炎症反应的主要免疫细胞——巨噬细胞会首先接触并识别入侵的病原体,然后产生大量趋化因子和一些炎性细胞因子,并进一步诱导大量中性粒细胞在受感染的乳腺中积聚清除病原菌,同时释放大量炎症介质和ROS,从而导致乳腺发生炎症反应(图1),即乳房炎[2]。奶牛乳房炎临床检出较多的致病菌主要有无乳链球菌、停乳链球菌、金黄色葡萄球菌和大肠杆菌,且这四种常见病原菌均产生了不同程度的耐药性[3~5];这会导致常规防治手段愈发难以见效,将来可能会面临无药可用的情况。
美国国家乳房炎委员会根据乳房及乳汁有无肉眼变化,将乳房炎分为非临床型乳房炎(即隐性乳房炎)和临床型乳房炎。隐性乳房炎是奶牛发病率最高的乳房炎,发病率是临床型乳房炎的20~40倍,其会导致产奶量缓慢降低、乳品质不断下降,给奶牛业造成巨大的经济损失[6]。在奶业发达的美国,奶牛养殖场每年的损失中有70%~80%是由隐性乳房炎引起产奶量下降造成的[1],这一情况在我国可能更加严峻。
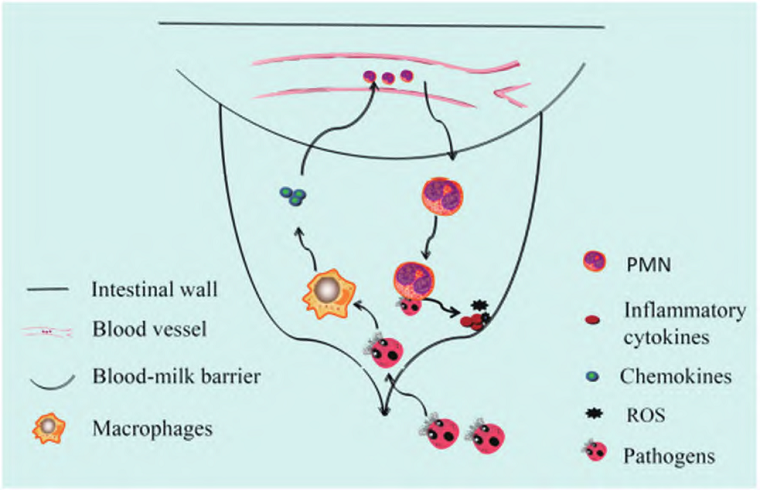
图1 病原体引起奶牛房炎的发展路线图[2]
1 微生态制剂对奶牛乳房炎的防治作用
临床上奶牛乳房炎的防治主要依赖抗生素,抗生素的滥用使牧场细菌出现严重耐药性,还造成乳制品中抗生素大量残留,严重威胁人类健康和环境安全[4]。许多研究表明,微生态制剂对奶牛乳房炎能起到很好的防治效果。最早,Greene等评估了乳酸菌的乳房内输注是否可以治愈患有亚临床型乳房炎的奶牛,结果表明乳酸菌治疗的治愈率为21.7%[7],相较于用抗生素头孢阿司匹林治疗的治愈率73.7%存在较大差距,但这让后面的研究者发现了益生菌在治疗奶牛乳房炎上的潜力。随后学者们相继报道了微生态制剂在降低乳房炎奶牛牛乳中体细胞数[8~12]、调控乳汁[12]和肠道[13]微生物上的优异表现,并发现其能显著提高乳品质[11,12]和产奶量[9]。杨静等发现通过饲喂或乳房灌注微生态活菌制剂均能对奶牛隐性乳房炎有一定的防治作用,且灌注见效快于饲喂[14]。
微生态制剂在实际使用中会受到菌种、活菌含量、使用方法和试验样本量等诸多因素的影响,本文将微生态制剂在奶牛乳房炎上的一些试验案例从菌种、活菌数、使用方法、样本量和实际效果等方面进行了归纳(表1),以供奶牛乳房炎微生态制剂的研发及现场使用时借鉴。如表1所示:王美秀等发现复合型微生态制剂可降低患隐性乳房炎奶牛乳中的体细胞数[8],虽然试验样本量较少,但也能展现微生态制剂对乳房炎的有效性;高鹏飞等使用复合乳酸菌制剂对不同地区牧场的2 624头奶牛进行试验,结果表明复合乳酸菌制剂具有改善奶牛隐性乳房炎、降低牛乳中体细胞数以及提高奶产量等作用[9];与此同时,杨慧娟等也对不同地区牧场的590头奶牛利用复合乳酸菌制剂进行防治试验,饲喂5~10d后,奶牛平均体细胞数显著降低23.8%~62.8%[10]。丁昕颖等利用嗜乳酸杆菌和枯草芽孢杆菌为主要菌种配制的微生态制剂可在一定程度上改善乳品质,能够有效降低乳中SCC[11]。Gao等也发现日粮中补充乳酸菌和酵母菌能改善乳品质,显著降低牛乳中体细胞数,恢复乳脂、乳蛋白和乳糖的含量,且乳酸菌对缓解乳房炎和改变乳汁微生物的效果好于酵母菌[12]。

2 微生态制剂在防治奶牛乳房炎上的作用机理
2.1 调节胃肠道菌群及代谢产物
乳房炎奶牛瘤胃中与炎症相关的微生物群和代谢物的丰度发生了显著变化[12]。肠道微生物群及其代谢产物,包括脂多糖(LPS)和短链脂肪酸(SCFAs),已被证明参与了乳房炎的发展[2]。Ma等通过定量PCR,比较了体细胞数低(<3×105个细胞/mL)和高(>1×106个细胞/mL)的奶牛的牛奶和粪便微生物特征,观察到在乳酸菌属和乳杆菌种水平上存在显著差异;乳房炎奶牛乳房炎病原体(肠球菌、链球菌和葡萄球菌)普遍增加,乳酸杆菌属(如L. salivarius , L. sakei , L. ruminis ,L. delbrueckii , L. buchneri , L. acidophilus )匮乏;粪便中乳酸杆菌与牛奶微生物群落和SCC相关联[15, 16];随后他们通过粪菌移植实验发现移植乳房炎患牛的粪便能够引起小鼠乳房炎症,益生菌干预能够降低小鼠乳房炎症程度[13];LPS是革兰氏阴性细菌细胞壁的主要成分,瘤胃中LPS过度会破坏瘤胃上皮,导致LPS进入血液和肝脏功能受损,LPS经血液循环进入乳腺,增加血液屏障的通透性,导致乳房炎症;而肠道微生物群产生的SCFAs对乳房炎症反应有保护作用,并有助于维持血乳屏障的功能[2]。这些结果表明益生菌能通过调节肠道菌群和代谢产物从而对乳房炎有一定的防治作用。
2.2 免疫调节
Beecher等将乳酸乳球菌DPC 3147的活菌注入健康牛乳腺,结果促进了乳汁和血液中IL-1β和IL-8基因表达,刺激宿主发生免疫反应[17]。Pellegrino等通过微生物学分析表明,在干奶期奶牛乳房内接种乳酸菌能增加血液和牛奶中能够识别金黄色葡萄球菌表位的IgG抗体[18]。日粮中添加乳酸菌和酵母菌能显著降低乳汁中炎性因子TNF-α、IL-6和IL-1β浓度和髓过氧化物酶(MPO)及N-乙酰-β-d-氨基葡萄糖苷酶(NAG)活性,KEGG分析发现乳酸菌处理组乳酸菌富集在与乳房炎和炎症有关的免疫系统疾病的传染病通路和免疫系统通路上[12]。鼠李糖乳杆菌能通过促进TLR2和NOD1的协同作用和减弱不依赖于ASC的NLRP3炎症小体激活,改善大肠杆菌引起的细胞形态和超微结构的破坏,限制有害的炎症反应[19];Li等的研究证明鼠李糖乳杆菌GR-1能诱导PINK1/Parkin介导线粒体自噬,清除受损线粒体并减少ROS 产生和NLRP3 炎性小体激活,减少大肠杆菌诱导的细胞凋亡,并能降低IL-1β、TNF-α等细胞因子水平;从而对大肠杆菌诱发的乳房炎具有预防和保护作用[20]。
以上这些研究均有力地证明了益生菌能够增强患乳房炎机体的免疫力,但值得注意的是,不同益生菌菌株对牛乳房炎的免疫调节可能存在较大的差异。例如,Fukuyama等发现嗜酸乳杆菌CRL2074调节效果较好,它降低了IL-1α、IL-1β、MCP-1、IL-8和CXCL3的表达,而鼠李糖乳杆菌CRL2084减少了IL-1β、MCP-1和IL-8表达[21];这是由于两株菌对LPS诱导引起的Toll样受体负调控因子调控的差异性所导致。CRL2074菌株预刺激BME细胞导致Toll样受体的三个负调节因子的表达上调,包括泛素编辑酶A20(也称为肿瘤坏死因子α诱导蛋白3,TNFAIP3)、单免疫球蛋白IL-1单受体(SIGIRR)和Toll相互作用蛋白(Tollip),而CRL2084预刺激仅上调Tollip表达[21]。
2.3 抵抗病原微生物
益生菌通过产生细菌素和短链脂肪酸[22]、修复黏膜屏障[23,24]和竞争性抑制[25,26]等方式来发挥抑菌抗炎作用的机制已被广泛认可。为了解决奶牛乳房炎的问题,研究人员筛选到许多能够抑制奶牛乳房炎病原菌尤其是金黄色葡萄球菌的益生菌[27~29];Gao等对乳汁微生物测序分析发现,乳酸菌能够抑制引起乳房炎的肠球菌和链球菌繁殖[12]。对于大肠杆菌引起的奶牛乳房炎,Wu等证明鼠李糖乳杆菌GR-1能够减少大肠杆菌对牛乳腺管细胞(BMECs)的黏附[19]。
3 抗奶牛乳房炎微生态制剂的研发
为设计一款绿色安全无残留、无耐药性的治疗乳房炎的产品,科研人员一直在不遗余力地探索。Espeche等为了设计一种预防牛乳房炎的益生菌产品,从不同奶牛场的初乳样品中分离出了117株乳酸菌(LAB),并评估了它们的益生性,例如抑制物质的产生、表面特性和胞外多糖(EPS)的产生;最终筛到了9株抑菌性能较佳的乳酸菌;并对其进行了抗生素耐药性和毒力因子等安全性评估[27]。Pellegrino等对牛奶中分离的12株乳酸菌的抗菌活性、对乳房炎致病菌的共聚集及自动抑制情况、对牛乳腺管上皮细胞(BTCEC)的黏附和生长动力学曲线进行了评估,筛选到Lactococcus lactissubsp. lactis CRL 1655和Lactobacillus perolens CRL 1724两株独特的乳酸菌,能够用于预防奶牛干奶期乳房炎的益生菌制剂中[28] 。陈宏伟等从鲜奶和乳制品样品中筛选获得5 株能够抑制金黄色葡萄球菌生长的乳酸菌,并从菌株上清液中提取到细菌素,经检测其具有抑菌活性,抑菌效价分别为457IU/mL、1 023IU/mL、676IU/mL、1 862IU/mL和1 023IU/mL[29]。
抗奶牛乳房炎微生态制剂的研发不仅仅限于饲料添加剂。在挤奶前后对奶头进行消毒是控制奶牛群乳房炎的关键一环,目前该消毒通常用的是化学消毒剂,会存在残留风险[27];研究人员为了解决这一问题,另辟蹊径,尝试用乳酸菌乳头喷雾剂来替代化药消毒剂。Alawneh等研究表明乳酸菌喷雾剂与碘喷雾剂对奶牛乳汁体细胞数的影响遵循类似的趋势,且与碘喷雾剂处理的奶牛相比,用乳酸菌产品处理的奶牛乳头末端评分和平均体细胞数增加的几率更低[30]。
4 展望
目前,饲料端禁抗、养殖端减抗等政策一步步落地实施,2021年10月21日,为切实加强兽用抗菌药综合治理,农业农村部农牧发(2021)31号文件制定了《全国兽用抗菌药使用减量化行动方案(2021—2025年)》,这一政策将极大限制奶牛乳房炎抗菌素用药量,致使奶牛场的生产特别是针对奶牛乳房炎的替抗已迫在眉睫。微生态制剂在奶牛乳房炎防治上具有巨大的潜力,无疑是替代抗生素防治奶牛乳房炎的有效选择之一。对于微生态添加剂生产企业来说,如何研制出更能角逐抗奶牛乳房炎的微生态制剂愈加重要。
作者:李筱雯、黄俊程、乔同、刘爽、周祖涛、肖运才
参考文献
[1] 郝景锋. 吉林省奶牛隐性乳房炎主要致病菌敏感中药筛选与初步应用[D].长春:吉林大学,2018.
[2] Hu X, Li S, Fu Y, et al. Targeting gut microbiota as a possible therapy for mastitis[J]. Eur J Clin Microbiol Infect Dis. 2019;38(8):1409-1423.
[3] 赵高乾, 王素英, 李广善, 等.奶牛乳房炎主要病原菌感染流行规律研究进展[J].中国畜牧兽医, 2019,46(11):3378-3386.
[4] 张行, 李新圃, 严勇, 等. 我国奶牛主要养殖区乳房炎病原菌区系分布及对抗生素敏感性的最新调查研究[J]. 中兽医医药杂志, 2020,39(04):5-9.
[5] 李宏胜, 罗金印, 李新圃, 等. 我国奶牛乳房炎病原菌区系调查及抗生素耐药性检测[A]. 中国畜牧兽医学会家畜内科学分会论文集[C].2011:8.
[6] 高潮. 奶牛隐性乳房炎病原微生物区系分析及金黄色葡萄球菌基因分型[D]. 合肥:合肥工业大学,2013.
[7] Greene WA, Gano AM, Smith KL, et al. Comparison of probiotic and antibiotic intramammary therapy of cattle with elevated somatic cell counts[J]. J Dairy Sci, 1991,74(9):2976-2981.
[8] 王美秀, 张爱荣, 郝永清. 防治奶牛隐性乳房炎微生态制剂的研究[J]. 黑龙江畜牧兽医, 2008,01:92-94.
[9] 高鹏飞, 程斌, 张善亭, 等. 复合乳酸菌制剂在防治奶牛乳房炎方面的应用研究[J]. 中国畜牧杂志, 2014,50(12):41-47.
[10] 杨慧娟, 张善亭, 崔景丽, 等. 乳酸菌微生态制剂防治奶牛隐性乳房炎应用研究[J]. 中国奶牛, 2014,17:51-54.
[11] 丁昕颖, 佟桂芝, 张淑芬, 等. 微生态制剂对奶牛乳成分和体细胞数的影响[J]. 饲料研究, 2016,13:28-30+44.
[12] Gao J, Liu YC, Wang Y, et al. Impact of yeast and lactic acid bacteria on mastitis and milk microbiota composition of dairy cows[J]. AMB Express, 2020,10(1):22.
[13] Ma C , Sun Z , Zeng B , et al . Cow-to-mouse fecal transplantations suggest intestinal microbiome as one cause of mastitis[J]. Microbiome, 2018,6(1):200.
[14] 杨静, 高淑琴, 王庆奎, 等. 微生态活菌制剂防治奶牛隐性乳房炎的效果试验[J]. 畜牧与饲料科学, 2012,33(08):105-106.
[15] Wang Y, Nan X, Zhao Y, et al. Rumen microbiome structure and metabolites activity in dairy cows with clinical and subclinical mastitis[J]. J Anim Sci Biotechnol, 2021,12(1):36.
[16] Ma C, Zhao J, Xi X, et al. Bovine mastitis may be associated with the deprivation of gut Lactobacillus[J]. Benef Microbes, 2016,7(1):95-102.
[17] Beecher C, Daly M, Berry DP, et al. Administration of a live culture of Lactococcus lactis DPC 3147 into the bovine mammary gland stimulates the local host immune response, particularly IL-1beta and IL-8 gene expression[J]. J Dairy Res, 2009,76(3):340-348.
[18] Pellegrino M, Berardo N, Giraudo J, et al. Bovine mastitis prevention: humoral and cellular response of dairy cows inoculated with lactic acid bacteria at the dry-off period[J]. Benef Microbes, 2017,8(4):589-596.
[19] Wu Q, Liu MC, Yang J, et al. Lactobacillus rhamnosus GR-1 Ameliorates Escherichia coli-Induced Inflammation and Cell Damage via Attenuation of ASC-Independent NLRP3 Inflammasome Activation[J]. Appl Environ Microbiol, 2015,82(4):1173-1182.
[20] Li Y, Zhu Y, Chu B, et al. Lactobacillus rhamnosus GR-1 Prevents Escherichia coli-Induced Apoptosis Through PINK1/Parkin-Mediated Mitophagy in Bovine Mastitis[J]. Front Immunol, 2021,12:715098.
[21] Fukuyama K, Islam MA, Takagi M, et al. Evaluation of the Immunomodulatory Ability of Lactic Acid Bacteria Isolated from Feedlot Cattle Against Mastitis Using a Bovine Mammary Epithelial Cells In Vitro Assay[J]. Pathogens, 2020,9(7):574.
[22] Sanders ME. Impact of probiotics on colonizing microbiota of the gut[J]. J Clin Gastroenterol, 2011,45 Suppl:S115-S119.
[23] Wu H, Xie S, Miao J, et al. Lactobacillus reuteri maintains intestinal epithelial regeneration and repairs damaged intestinal mucosa[J]. Gut Microbes, 2020,11(4):997-1014.
[24] Hou Q, Ye L, Liu H, et al. Lactobacillus accelerates ISCs regeneration to protect the integrity of intestinal mucosa through activation of STAT3 signaling pathway induced by LPLs secretion of IL-22[J]. Cell Death Differ, 2018,25(9):1657-1670.
[25] Kamiya S, Yonezawa H, Osaki T. Role of Probiotics in Eradication Therapy for Helicobacter pylori Infection[J]. Adv Exp Med Biol, 2019,1149:243-255.
[26] Muñoz-Quezada S, Bermudez-Brito M, Chenoll E, et al. Competitive inhibition of three novel bacteria isolated from faeces of breast milk-fed infants against selected enteropathogens[J]. Br J Nutr, 2013,109 Suppl 2:S63-S69.
[27] Espeche MC, Pellegrino M, Frola I, et al. Lactic acid bacteria from raw milk as potentially beneficial strains to prevent bovine mastitis[J]. Anaerobe, 2012,18(1):103-109.
[28] Pellegrino MS , Frola ID , Natanael B , et al . In Vitro Characterization of Lactic Acid Bacteria Isolated from Bovine Milk as Potential Probiotic Strains to Prevent Bovine Mastitis[J].Probiotics Antimicrob Proteins, 2019,11(1):74-84.
[29] 陈宏伟, 姜云, 郭雪峰, 等. 抑制奶牛乳房炎源金黄色葡萄球菌的乳酸菌的筛选[J]. 中国预防兽医学报, 2020,42(02):128-132.
[30] Alawneh JI , James AS , Phillips N, et al . Efficacy of a Lactobacillus-Based Teat Spray on Udder Health in Lactating Dairy Cows[J].Front Vet Sci, 2020,7:584436.
上一篇:没有了



